Роль цинка в физиологии ЦНС
Шаблон
нутрицифтической формулы
В головном мозге цинк в ионной форме (Zn2+) в значительных количествах присутствует во многих (но не во всех) глутаматергических нервных окончаниях, высвобождается при активности нейронов и имеет важное значение для контроля физиологических и патофизиологических функций мозга. Спектр действия цинка в работе ЦНС наиболее широк, если сравнивать с такими элементами, как Cu, Fe, Ca, Mg, K, Na. В мозге человека цинк присутствует в трех фракциях – везикулярной, в синаптических пузырьках и мембраносвязанной. В отростках нейронов концентрация элемента несколько раз выше из-за присутствия в везикулярной фракции – отсюда ионы цинка могут поступать в синаптическую щель при электростимуляции и влиять на активность нейромедиаторов [Crews et al., 2001]. В области сосудистого сплетения ствола цинк реализует свое протекторное действие, способствуя созреванию и активации Т-лимфоцитов через фосфотрансферазы и тимидинкиназы [Кудрин с соавт., 2000]. Цинк необходим для поддержания синаптической пластичности, и предположение о том, что высокие концентрации ионов цинка, отмечаемые в неокортексе, миндалевидном теле и гиппокампе, регулируют синаптическую передачу, подтверждаются обнаружением сайтов связывания Zn на мембранах синапсов [Smart et al., 2004; Paoletti et al., 2009]. Например, рецепторы NMDA (NMDAR - ионотропные рецепторы глутамата, селективно связывающие N-метил-D-аспартат) имеют несколько сайтов связывания цинка, позволяющих воспринимать концентрацию этого металла в достаточно широком диапазоне [Rachline et al., 2005]. В низких концентрациях цинк опосредует неконкурентное ингибирование NMDAR, а в высоких – блокирует ионные каналы. Иными словами, цинк выступает в качестве ко-трансмиттера [Qian, Noebels; 2007; Sensi et al., 2009].
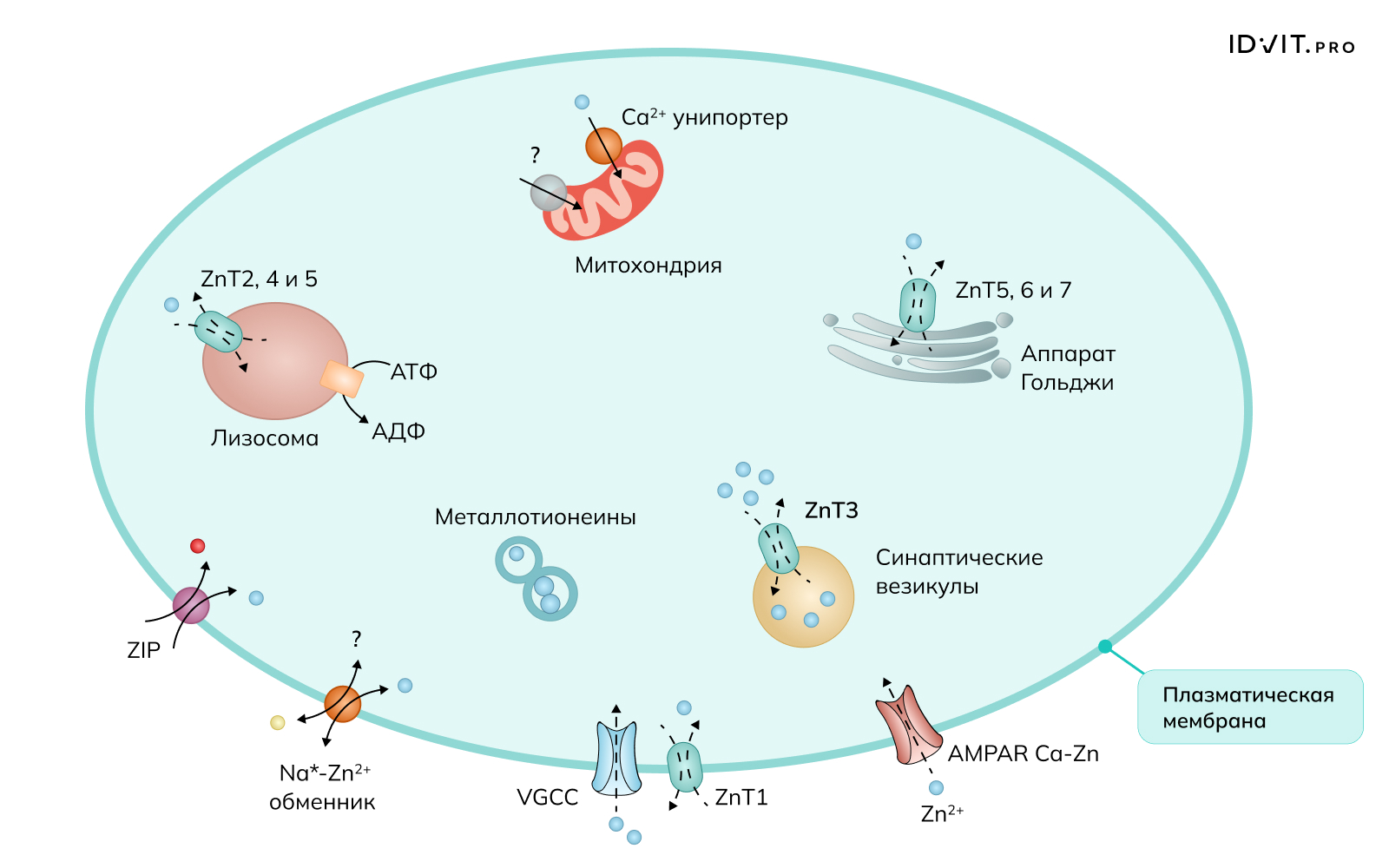
Регуляция уровня цинка в тканях ЦНС осуществляется при участии кальция и натрия. Zn2+ поступает в нейроны главным образом через активированные потенциалзависимые Ca2+-каналы (VGCC) и Ca2+- и Zn2+-проницаемые GluR2-рецепторы AMPA (α-амино-3-гидрокси-5-метил-4-изоксазолпропионовая кислота). На уровне плазматической мембраны транспортер 1 Zn2+ (ZnT1) контролирует отток Zn2+, но может также взаимодействовать с VGCC L-типа, который регулирует приток Ca2+ и Zn2+. Обменник Na+ –Zn2+ может перемещать Zn2+ в нейроны или из них в зависимости от градиента Na+; кроме того, белки, импортирующие Zn2+ (ZIP), могут действовать как ко-транспортеры H+ и облегчать приток ионов цинка. Внутри нейронов везикулярные ZnT действуют как обменники H+–Zn2+ и располагаются на аппарате Гольджи и других секреторных везикулах. Митохондрии также секвестрируют Zn2+ посредством активации как унипортера Ca2+, так и независимого от унипортера Ca2+-механизма, который еще не идентифицирован на молекулярном уровне. Наконец, металлотионеины вносят большой вклад в поддержание гомеостаза Zn2+, поскольку они являются основными Zn2+-буферными пептидами в нейронах.
Дисбаланс цинка может быть результатом не только недостаточного поступления с пищей, но и нарушения активности белков-транспортеров цинка и цинк-зависимой регуляции метаболических путей. Известно, что некоторые нейродегенеративные процессы (болезнь Альцгеймера, депрессии, возрастные ухудшения когнитивных функций) связаны с нарушением гомеостаза цинка [Tyszka-Czochara et al., 2014; Li et al., 2022; Choi et al., 2020].
Список литературы
Пример базовой сигнатуры
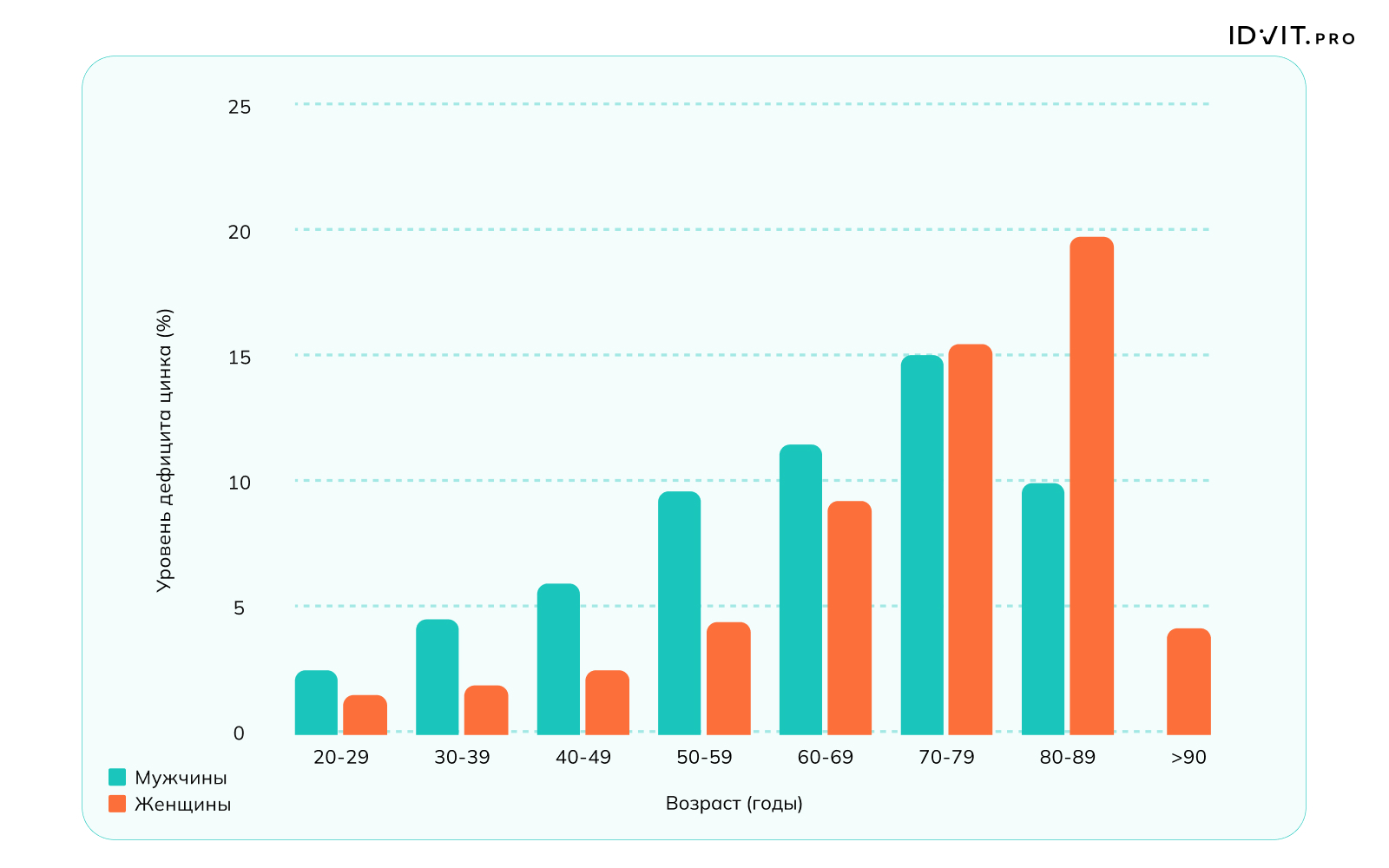
СкачатьВ начале 21 века было отмечено значительное улучшение эпидемиологической ситуации с дефицитом цинка, что связывают с повышением качества питания и точности диагностики. Тем не менее, в настоящее время частота дефицита цинка остается достаточно высокой и затрагивает около 10% населения в развитых странах и до 40% в развивающихся. К группе риска дефицита цинка относятся беременные женщины, кормящие матери и их дети, люди старше 60 лет. В исследовании Yasuda, Tsutsui, 2016 года, включавшем 25 500 участников, дефицит в равной степени затрагивал и мужчин, и женщин в возрасте 70-79 лет, а в возрастной группе 20-69 чаще отмечался у мужчин.
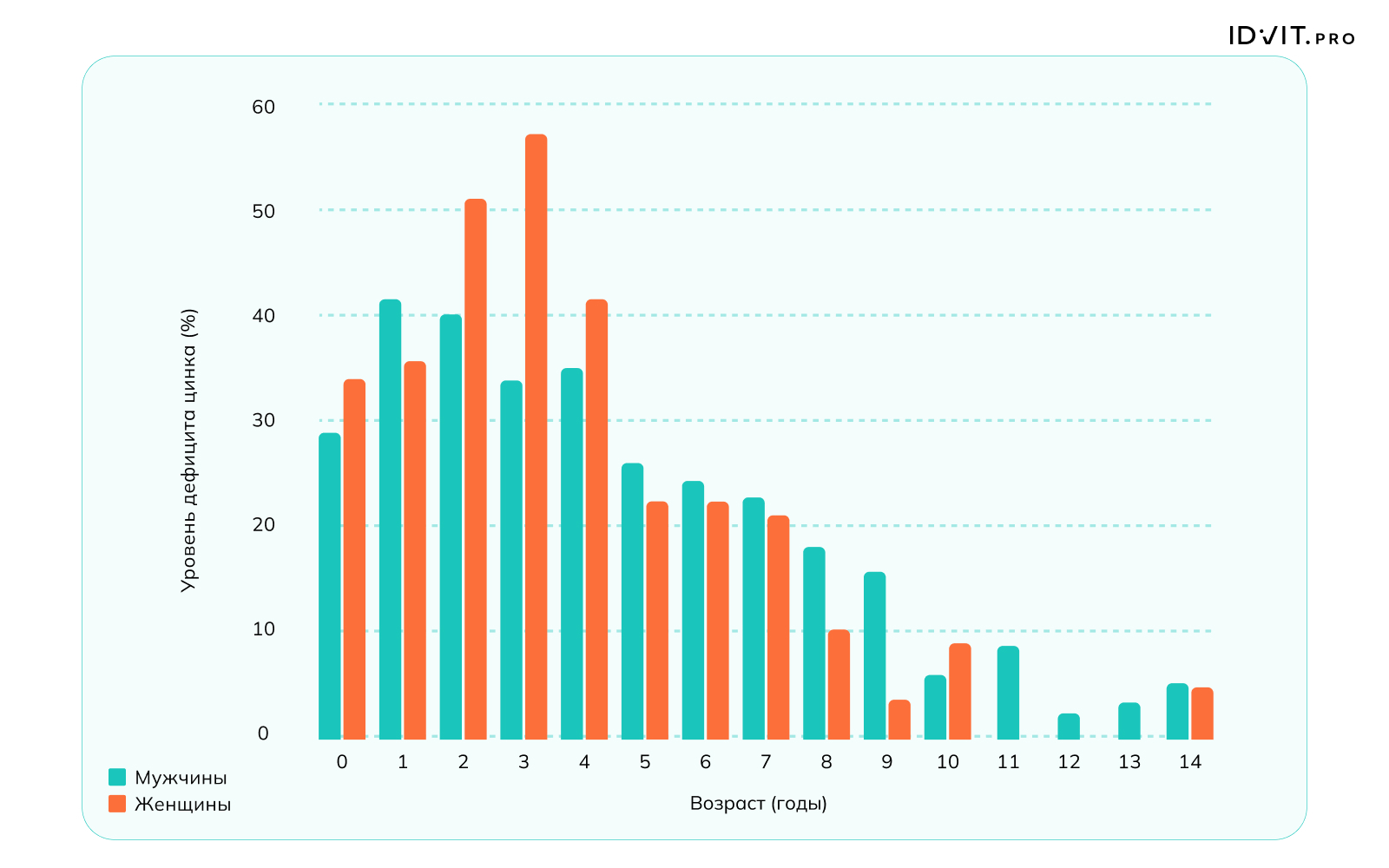
У детей в возрасте 0-15 лет (n=2685) частота дефицита варьировала в значительных пределах и достигала 50-60%, особенно в раннем детском возрасте (0-4 года), что связывают с недостатком цинка в молоке матери и молочных смесях, а также со сниженной абсорбции цинка в кишечнике.
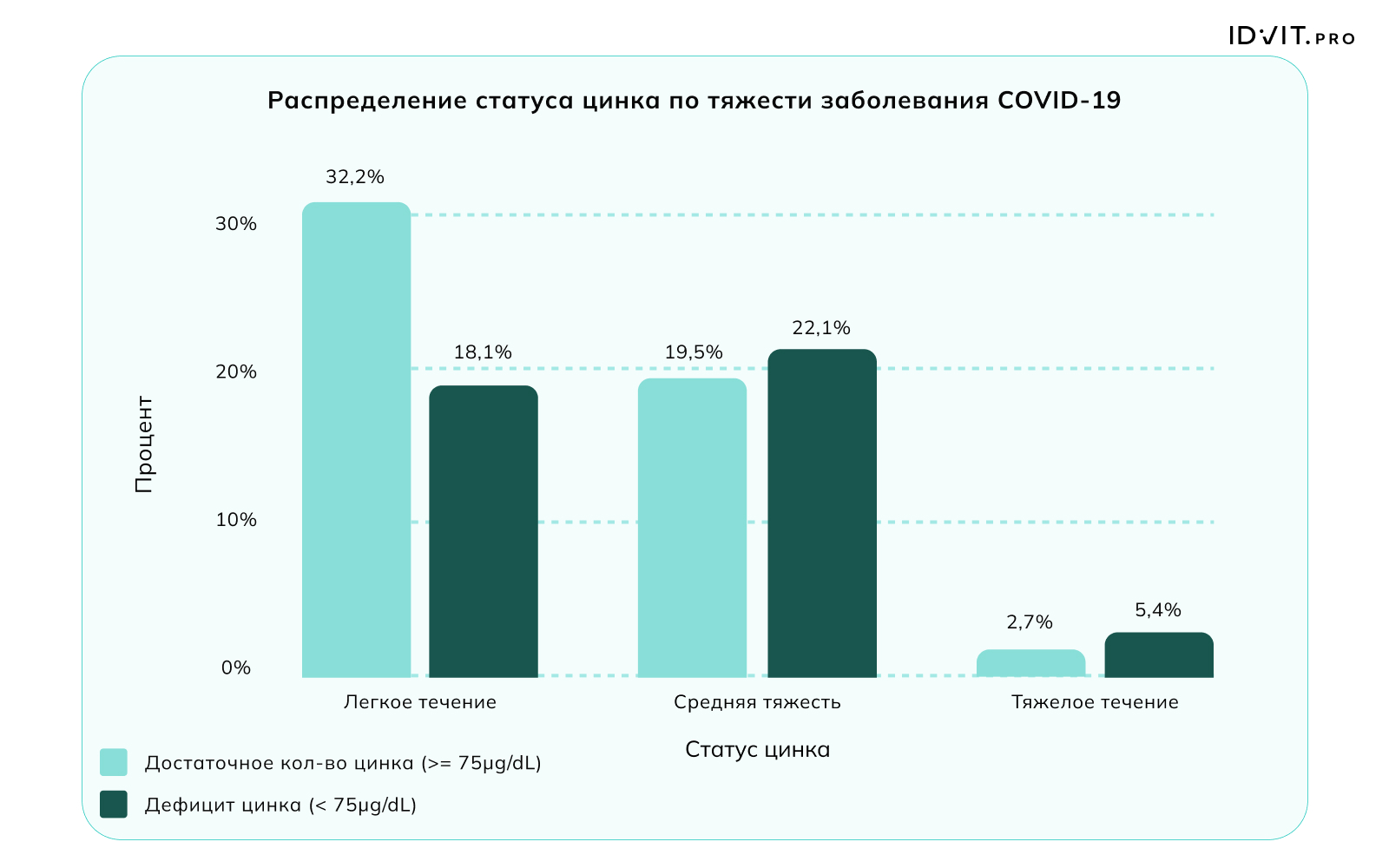
В период пандемии SARS-Cov2 (COVID-19) проведенные масштабные исследования позволили подтвердить более ранние результаты по оценке распространенности дефицита цинка среди населения разных стран и соотнести недостаток этого микроэлемента с тяжестью течения инфекции:
 Вход
Вход